4月1日,生命学院黄志伟教授课题组研究发现了新型Anti-CRISPR蛋白,并揭示其抑制type V型Cas12a活性的新机制。该项成果以《Anti-CRISPR蛋白通过乙酰化修饰type V型Cas12a使之失活》(An anti-CRISPR protein disables type V Cas12a by acetylation)为题发表在《自然结构和分子生物学》(Nature Structural & Molecular Biology)杂志上,同时该杂志的News & Views栏目作为研究亮点对该成果进行了专题报道。
CRISPR-Cas适应性免疫系统为细菌和古细菌对抗噬菌体和质粒入侵提供了核酸序列特异性的防御机制。CRISPR-Cas系统分为6个亚型,其中II型Cas9和V 型Cas12a(Cpf1)系统被广泛应用于基因组编辑和多种多样的生物技术应用。在噬菌体感染细菌过程中,细菌的Cas效应蛋白Cas9或Cas12a在RNA指导下通过PAM-interacting (PI)结构域识别位于靶向双链DNA的PAM序列并解旋靶向dsDNA的两条链,从而Cas效应蛋白核酸酶结构域切割靶向dsDNA的两条链,抵御噬菌体的入侵。作为对CRISPR-Cas免疫系统的反击,噬菌体通过进化出anti-CRISPR蛋白逃逸细菌CRISPR-Cas防御系统。
课题组首先通过生物信息学方法寻找到一类anti-Cas12a候选蛋白,再通过生化和细菌实验发现其中的一个anti-Cas12a蛋白AcrVA5具有抑制Moraxella bovoculi (Mb) Cas12a活性的能力。但意外的是,凝胶迁移实验发现AcrVA5蛋白并不结合MbCas12a-crRNA,这个现象与以前研究发现的anti-CRISPR蛋白通过结合Cas蛋白阻止靶向DNA的结合或者阻止Cas蛋白核酸内切酶活性完全不一样。他们推测MbCas12a的抑制活性可能是通过一种未知的酶修饰而实现的。而通过对AcrVA5蛋白序列分析以及实验发现AcrVA5蛋白具有乙酰基转移酶活性,进一步的生化实验证实AcrVA5蛋白通过乙酰转移酶活性使得MbCas12a蛋白失活。
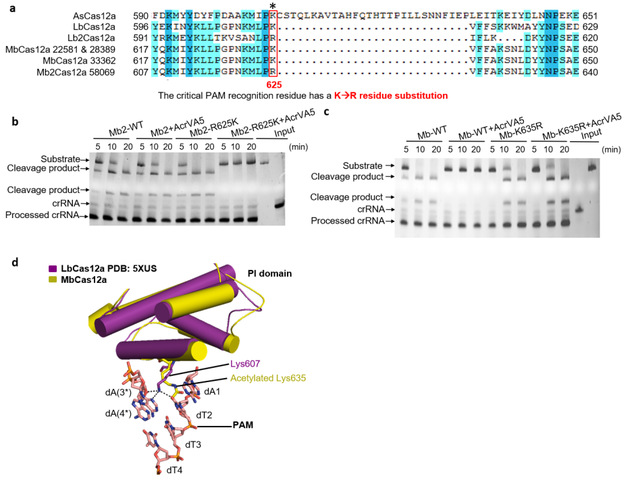
课题组进而寻找AcrVA5在MbCas12a蛋白上的乙酰化修饰位点。这类乙酰基转移酶通常修饰底物蛋白上的赖氨酸(K)残基,由于K635是MbCas12a的PI结构域识别底物DNA的PAM序列的关键氨基酸,因此他们推测MbCas12a的K635可能是AcrVA5乙酰化修饰从而失活的关键位点。MbCas12a的K635R突变试验证实该突变体活性不能被AcrVA5抑制,同时发现AcrVA5对另一Mb strain(Mb2)的Cas12a(识别PAM序列的关键氨基酸是精氨酸而不是赖氨酸)没有抑制能力,这些实验结果表明AcrVA5蛋白发挥其抑制作用主要依靠乙酰化Cas12a蛋白PAM识别位点的氨基酸K残基发挥作用的。有趣的是,Mb2Cas12a的R625K突变体的活性能够完全被AcrVA5抑制,该结果结合质谱分析从而证实AcrVA5蛋白通过修饰MbCas12a蛋白的识别底物PAM的关键K635残基使之失活。而Cas12a蛋白的结构揭示K635的乙酰化不仅使dT2和dA(3*)之间失去氢键相互作用,也可能形成空间位阻,阻止了dsDNA的结合,从而使Cas12a失去dsDNA切割活性。
该研究揭示的anti-CRISPR通过乙酰转移酶活性修饰并抑制CRISPR蛋白的机制和该课题组以前发现的anti-Cas9的抑制机制完全不一样,anti-Cas9是通过直接结合Cas9的底物结合位点从而抑制Cas9的活性。该研究首次揭示了anti-CRISPR蛋白可以通过酶修饰作用抑制细菌CRISPR-Cas免疫防御系统的新机制和策略,为噬菌体和细菌免疫系统(CRISPR-Cas)之间的进攻防御策略提供了新观点。该发现可以用于在体内精确控制Cas12a的活性,提高基因编辑的精确性。这也是该团队在病原与宿主相互作用和基因编辑分子机制研究领域取得的又一重要研究成果。
黄志伟教授为该研究论文的通讯作者,博士研究生董立永和关晓宇,北京大学高宁组的李宁宁博士为该论文的并列第一作者。张帆副教授、朱玉威博士对该研究做出了重要贡献。上海同步辐射中心为晶体数据收集提供了支持。本项目受到国家自然科学基金委、哈工大青年科学家工作室等基金的资助。
文章链接:
https://www.nature.com/articles/s41594-019-0206-1