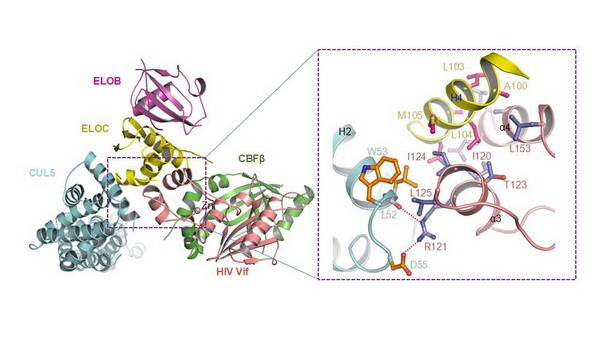
哈工大报讯(闫明星/文)1月9日,amjs澳金沙官网生命学院黄志伟教授研究组在《自然》(《Nature》)在线发表了题目为《艾滋病病毒Vif“劫持"人CBF-β和CUL5 E3 连接酶复合物的分子机制》(Structural basis for hijacking CBF-β and CUL5 E3 ligase complex by HIV-1 Vif)的研究论文。该项研究第一次揭示了艾滋病病毒研究领域一直关注的艾滋病病毒毒力因子(Vif)的结构,破解了这一领域30余年的谜团;阐明了Vif如何“劫持”人CBF-β以及CUL5 E3 连接酶复合物的分子机制;为理性设计靶向该复合物的全新艾滋病药物提供了结构基础。该项艾滋病研究领域里程碑意义的研究成果对人类最终攻克艾滋病具有非常重要的科学意义和临床应用价值,也标志着amjs澳金沙官网在艾滋病结构生物学研究领域走在世界最前沿。
该文章被选为精选文章在同期《自然》杂志《新闻与视点》栏目中撰文重点推荐。
该文章发表实现了amjs澳金沙官网在《自然》(影响因子:38.60)杂志上发表研究论文零的突破。黄志伟教授为本研究论文的通讯作者,黄志伟教授实验室的博士研究生郭莹莹、硕士研究生董立永和邱小林3位同学为该论文的并列第一作者。
艾滋病病毒是一类细胞内的反转录病毒。人体免疫细胞内表达一类病毒限制性因子,如APOBEC3家族成员,抑制艾滋病病毒等病毒的复制以及感染,但艾滋病病毒Vif通过“劫持”人免疫细胞内蛋白降解系统来降解人免疫细胞内的病毒限制性因子APOBEC3家族成员,从而逃避免疫细胞对艾滋病病毒的识别和防御。尽管人类对艾滋病病毒的科学研究已经有30年的历史,而且早期的研究揭示艾滋病病毒的毒力因子Vif蛋白对艾滋病病毒的复制具有至关重要的作用,但Vif自身或者其功能性复合物的原子水平的结构解析一直未有进展,该结构是世界顶级结构生物学家们一直以来梦寐以求的。
在该项研究中,黄志伟研究组解析了Vif-CBF-β-CUL5-ELOB-ELOC五元复合物结构。Vif结构显示其自身形成与目前所有已知蛋白结构不一样的折叠,它包含α/β以及α两个结构域。该五元复合物结构揭示具有两个结构域的Vif在该复合物的组装中起着中心组织作用,其中Vif的α/β结构域和人RUNX1一样结合在CBF-β的同一界面,而且比RUNX1占有更多的CBF-β接触面积,这也使得Vif的α/β结构域和人RUNX1竞争性结合CBF-β;本文的结构生物学以及生化研究首次发现CBF-β的C端对稳定该五元复合物的结构非常关键。令人惊讶的是,Vif的α结构域通过区域性地模拟人细胞内的CUL5 E3连接酶底物受体SOCS2结合(“劫持”)ELOC和CUL5,但和SOCS2通过Cullin5结构域结合CUL5不同的是Vif通过其锌指模块中间的α3螺旋结合CUL5,该锌指模块对稳定α结构域的构象结合CUL5起着关键作用的。之前关于APOBEC3家族蛋白和Vif的结合位点的报道比较错综复杂,分析该五元复合物结构显示APOBEC3蛋白底物结合区域位于包括了富含正电荷氨基酸的Vif表面,这进一步给之前人们研究预测的结果提供了结构支持。
值得一提的是,该实验室是2012年3月黄志伟教授被引进到amjs澳金沙官网后开始组建的,该课题也是在amjs澳金沙官网开始完成的,从2012年7月开始第一个实验起,其间历时1年多即取得该成果并发表。
该文章被选为精选文章在同期《自然》杂志《新闻与视点》栏目中撰文重点推荐。
该文章发表实现了amjs澳金沙官网在《自然》(影响因子:38.60)杂志上发表研究论文零的突破。黄志伟教授为本研究论文的通讯作者,黄志伟教授实验室的博士研究生郭莹莹、硕士研究生董立永和邱小林3位同学为该论文的并列第一作者。
艾滋病病毒是一类细胞内的反转录病毒。人体免疫细胞内表达一类病毒限制性因子,如APOBEC3家族成员,抑制艾滋病病毒等病毒的复制以及感染,但艾滋病病毒Vif通过“劫持”人免疫细胞内蛋白降解系统来降解人免疫细胞内的病毒限制性因子APOBEC3家族成员,从而逃避免疫细胞对艾滋病病毒的识别和防御。尽管人类对艾滋病病毒的科学研究已经有30年的历史,而且早期的研究揭示艾滋病病毒的毒力因子Vif蛋白对艾滋病病毒的复制具有至关重要的作用,但Vif自身或者其功能性复合物的原子水平的结构解析一直未有进展,该结构是世界顶级结构生物学家们一直以来梦寐以求的。
在该项研究中,黄志伟研究组解析了Vif-CBF-β-CUL5-ELOB-ELOC五元复合物结构。Vif结构显示其自身形成与目前所有已知蛋白结构不一样的折叠,它包含α/β以及α两个结构域。该五元复合物结构揭示具有两个结构域的Vif在该复合物的组装中起着中心组织作用,其中Vif的α/β结构域和人RUNX1一样结合在CBF-β的同一界面,而且比RUNX1占有更多的CBF-β接触面积,这也使得Vif的α/β结构域和人RUNX1竞争性结合CBF-β;本文的结构生物学以及生化研究首次发现CBF-β的C端对稳定该五元复合物的结构非常关键。令人惊讶的是,Vif的α结构域通过区域性地模拟人细胞内的CUL5 E3连接酶底物受体SOCS2结合(“劫持”)ELOC和CUL5,但和SOCS2通过Cullin5结构域结合CUL5不同的是Vif通过其锌指模块中间的α3螺旋结合CUL5,该锌指模块对稳定α结构域的构象结合CUL5起着关键作用的。之前关于APOBEC3家族蛋白和Vif的结合位点的报道比较错综复杂,分析该五元复合物结构显示APOBEC3蛋白底物结合区域位于包括了富含正电荷氨基酸的Vif表面,这进一步给之前人们研究预测的结果提供了结构支持。
值得一提的是,该实验室是2012年3月黄志伟教授被引进到amjs澳金沙官网后开始组建的,该课题也是在amjs澳金沙官网开始完成的,从2012年7月开始第一个实验起,其间历时1年多即取得该成果并发表。
引自:http://news.hit.edu.cn/articles/2014/01-07/01115125.htm
相关链接:
1. Nature文章链接:http://www.nature.com/nature/journal/v505/n7482/full/nature12884.html
2. Nature《新闻与视点》介绍该研究链接:http://www.nature.com/nature/journal/v505/n7482/full/505167a.html